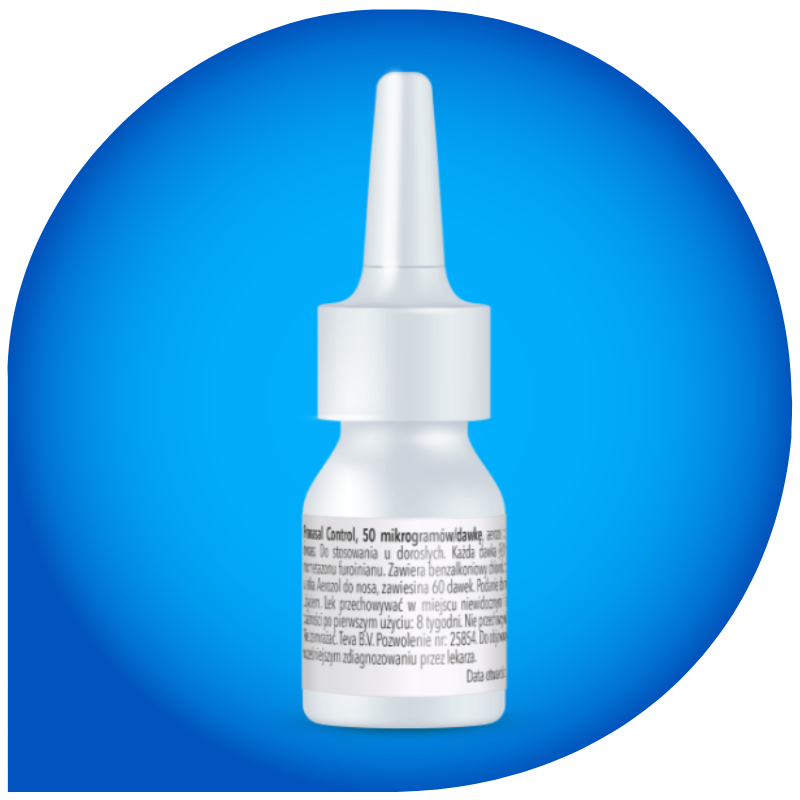
Co zawiera lek Pronasal Control?
| Substancją czynną leku jest mometazonu furoinian. Jedna dawka leku (0,1 ml) dostarcza 50 mikrogramów mometazonu furoinianu, który należy do grupy leków nazywanych kortykosteroidami. Mometazonu nie należy mylić ze steroidami anabolicznymi, które są używane niezgodnie z przeznaczeniem przez niektórych sportowców. | |
| |
Pozostałe składniki to: mieszanina (Avicel RC – 591) o składzie: mikrokrystaliczna celuloza z karmelozą sodową; glicerol; sodu cytrynian (dwuwodny); kwas cytrynowy jednowodny; polisorbat 80; benzalkoniowy chlorek; woda do wstrzykiwań. |
Mometazon zawarty w Inteligentne leczenie zatkanego nosa*
| Lek długo pozostaje w nosie i nie spływa do gardła.1 |
| Najwyższa masa dawki i dokładność dotarcia.1 |
*lek poprawia drożność i uczucie zatkanego nosa w objawach ANN
Efektywne pokrycie powierzchni błony śluzowej nosa1 |
|||||||||
|

1. Kołodziejczyk MK, Nachajski MJ, Kołodziejska J i wsp. Ocena technologiczno-farmaceutyczna zawiesin donosowych z furoinianem mometazonu. Terapia 12/2016; str. 9-10.
2. Po trzech miesiącach ciągłego stosowania zalecana konsultacja z lekarzem. Źródło: ChPL Pronasal Control.
|
To jest lek. Dla bezpieczeństwa stosuj go |
1. NAZWA PRODUKTU LECZNICZEGO Pronasal Control, 50 mikrogramów/dawkę, aerozol do nosa, zawiesina 2. SKŁAD JAKOŚCIOWY I ILOŚCIOWY Każde naciśnięcie pompki (0,1 ml) dostarcza odmierzoną dawkę 50 mikrogramów mometazonu furoinianu (w postaci mometazonu furoinianu jednowodnego). Całkowita masa jednej dawki wynosi 100 mg. Substancja pomocnicza o znanym działaniu: 20 mikrogramów benzalkoniowego chlorku na dawkę. Pełny wykaz substancji pomocniczych, patrz punkt CHPL 6.1. 3. POSTAĆ FARMACEUTYCZNA Aerozol do nosa, zawiesina Biała do prawie białej, nieprzezroczysta zawiesina. pH: od 4,3 do 4,9. Osmolalność: od 270 do 330 mOsm/kg 4. SZCZEGÓŁOWE DANE KLINICZNE 4.1 Wskazania do stosowania Produkt leczniczy Pronasal Control wskazany jest do stosowania u osób dorosłych (w wieku powyżej 18 lat) w leczeniu objawów sezonowego, alergicznego zapalenia błony śluzowej nosa po wcześniejszym zdiagnozowaniu przez lekarza. 7. PODMIOT ODPOWIEDZIALNY POSIADAJĄCY POZWOLENIE NA DOPUSZCZENIE DO OBROTU Teva B.V. Swensweg 5 2031 GA Haarlem Holandia Numer pozwolenia na dopuszczenie do obrotu: 25854 wydane przez Prezesa URPLWMiPB 10. DATA ZATWIERDZENIA LUB CZĘŚCIOWEJ ZMIANY TEKSTU CHARAKTERYSTYKI PRODUKTU LECZNICZEGO 2022.11.09 Kategoria dostępności OTC - Produkt dostępny bez przepisu lekarza. Charakterystyka Produktu Leczniczego dostępna na stronie www.teva.pl.